डाल्टन का परमाणु सिद्धांत ( Atomic Theory Of Dalton )
सन् 1808 में जॉन डॉल्टन नाम के ब्रिटिश स्कूल अध्यापक ने परमाणु की व्याख्या करने के लिए एक सिद्धांत दिया । यह परमाणु सिद्धांत रासायनिक संयोजन , द्रव्यमान संरक्षण एवं निश्चित अनुपात के नियमों के आधार पर दिया गया था । जॉन डॉल्टन इसके मुख्य अभिगृहित निम्न है -
( 1 ) प्रत्येक पदार्थ छोटे - छोटे कणों से मिलकर बना होता है , जिन्हें परमाणु ( Atoms ) कहते है ।
( 2 ) परमाणु अविभाज्य कण होते है ।
( 3 ) एक ही तत्व के सभी परमाणु समान अर्थात् भार , आकार व रासायनिक गुणधर्मों में समान होते है ।
( 4 ) भिन्न - भिन्न तत्वों के परमाणु भार , आकार व रासायनिक गुणधर्मों में भिन्न - भिन्न होते है ।
( 5 ) अलग - अलग तत्वों के परमाणु सदैव छोटी - छोटी पूर्ण संख्याओं के सरल अनुपात में संयोग कर यौगिक बनाते है ।
( 6 ) रासायनिक अभिक्रियाओं में परमाणु केवल पुनर्व्यवस्थित होते है । इन्हें रासायनिक अभिक्रिया के द्वारा न तो बनाया जा सकता है , न ही नष्ट किया जा सकता हैं ।
डॉल्टन का परमाणु सिद्धांत बहुत सारे तथ्यों की व्याख्या नहीं कर पाया परन्तु इसके द्वारा परमाणु के बारे में वैज्ञानिक तथा प्रायोगिक तथ्यों के आधार पर अग्रिम अन्वेषणों की पुख्ता नींव रखी गई । 19 वीं शताब्दी के अंत तक यह ज्ञात हुआ कि परमाणु में कुछ और छोटे - छोटे कण भी विद्यमान होते है । इन अवपरमाण्विक कणों की उपस्थिति के कारण परमाणु संरचना में और संशोधन हुए ।
थॉमसन का परमाणु मॉडल ( Atomic Model Of Thomson )
अब तक इलेक्ट्रॉन व प्रोटॉन की खोज हो चुकी थीं । परमाणु में इन इलेक्ट्रॉन व प्रोटॉन की आन्तरित संरचना को समझने के लिए मॉडल विकसित किए जा रहे थे । परमाणु संरचना संबधी पहला मॉडल सन् 1898 में सर जे.जे. थॉमसन ने प्रस्तुत किया था । उनके अनुसार परमाणु 10-10 मीटर के आकार का एक धनावेशित गोला होता है । जिसमें समान मात्रा में ऋणावेशित इलेक्ट्रॉन वितरित होते है । इसे प्लम पुडिंग मॉडल भी कहा जाता है । यह एक प्रकार का क्रिसमस केक है यहाँ धनादेश को पुडिंग की तरह माना गया है , जिसमें इलेक्ट्रॉन प्लम की तरह लगे होते है । इसे भारतीय परिप्रेक्ष्य में बूंदी के लड्डू या तरबूज की तरह भी समझा जा सकता है । तरबूज का लाल भाग धनवेश की तरह तथा इसमें लगे बीज इलेक्ट्रॉन की तरह होते है । इस मॉडल में थॉमसन ने स्पष्ट किया था कि परमाणु में धनावेश तथा ऋणावेश की मात्रा समान होती है तथा परमाणु वैद्युतीय रूप से उदासीन होते है ।
 |
| थॉमसन का परमाणु मॉडल |
इस सिद्धान्त से परमाणु का विद्युतीय रूप से उदासीन होना तो स्पष्ट हो गया परन्तु आगे यह प्रतिरूप रदरफोर्ड के स्वर्ण पत्र प्रयोग को नहीं समझा सका । अतः यह सिद्धांत शीघ्र ही निरस्त कर दिया गया और केवल ऐतिहासिक महत्व का रह गया ।
रदर फोर्ड का स्वर्ण पत्र प्रयोग ( Rutherford's Gold Foil Experiment )
अर्नेस्ट रदरफोर्ड तथा उनके शिष्यों ने सन् 1911 में सोने की बहुत पतली झिल्ली ( Gold Foil ) पर α- कणों की बमबारी का प्रयोग किया । इससे सोने की पतली झिल्ली ( मोटाई 10-7 मीटर या 100 nm ) पर उच्च ऊर्जा वाले α- कणों ( He के नाभिक ) की बमबारी की गई । झिल्ली के चारों तरफ जिंक सल्फाइड से लेपित वृत्ताकार पर्दा रखा गया जिससे कि बमबारी के बाद α- कण इस पर्दे से टकरा कर फ्लैश ( Flash ) ( स्फूरदिप्ती ) उत्पन्न करता है । इस प्रकार α- कण की दिशा ज्ञात हो जाती है ।
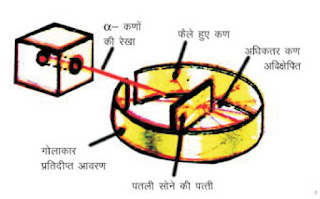 |
| रदरफोर्ड का स्वर्णपत्र प्रयोग |
 |
| स्वर्ण धातु के नाभिक द्वारा α- कणों का प्रकीर्णन |
उनके इस प्रयोग से प्राप्त प्रेक्षण इस प्रकार थे -
( 1 ) अधिकांश α - कण सोने की झिल्ली से बिना विक्षेपित हुए सीधे ही निकल गए ।
( 2 ) बहुत कम α- कण कुछ अंश कोण से विक्षेपित हो गये ।
( 3 ) 20,000 α- कणों में एक α - कण का विक्षेपण 180° के कोण से हुआ ।
इस प्रयोग से प्राप्त प्रेक्षण अत्यंत अनपेक्षित थे । स्वयं रदरफोर्ड के शब्दो में “ यह परिणाम उतना ही अविश्वसनीय था जैसे अगर आप एक 14 इंच तोप के गोले को टिशू पेपर के टुकड़े पर मारें और वह लौट कर आपको ही चोट पहुँचाये । ” इन प्रेक्षणों के आधार पर रदरफोर्ड ने निम्नलिखित निष्कर्ष निकाले -
1 . परमाणु का अधिकांश भाग खोखला और आवेशहीन होता है इसलिए अधिकांश α - कण सीधे ही निकल जाते है ।
2 . कुछ α - कण विक्षेपित हो जाते है इसलिए निश्चित है कि उनपर प्रबल प्रतिकर्षण बल लगा होता है । अतः समस्त धनावेश परमाणु के अंदर एक जगह केन्द्रित होना चाहिए ।
3 . परमाणु में धनावेश का आयतन उसके कुल आयतन की तुलना में बहुत कम होता है । इस धनावेशित आयतन को नाभिक कहा । परमाणु का व्यास लगभग 10-10 मीटर तथा नाभिक का व्यास लगभग 10 -15 मीटर होता है ।
उपरोक्त निष्कर्षों के आधार पर रदरफोर्ड ने परमाणु का निम्नांकित मॉडल प्रस्तुत किया -
( 1 ) परमाणु का सम्पूर्ण धनवेश तथा द्रव्यमान उसके मध्य नाभिक में कन्द्रित होता है ।
( 2 ) परमाणु का अधिकांश भाग रिक्त होता है जिसमें चारों और इलेक्ट्रॉन वृत्ताकार पथों में तीव्र गति से घूमते है । इन वृत्ताकार पथों को कक्षा ( Orbit ) कहते है ।
( 3 ) परमाणु विद्युत उदासीन होता है । अतः निश्चित रूप से परमाणु में जितने इलेक्ट्रॉन होते है । उतनी ही संख्या में नाभिक में प्रोटॉन उपस्थित होते है ।
 |
| रदरफोर्ड का परमाणु मॉडल |
रदरफोर्ड का परमाणु मॉडल सौर मॉडल का प्रतिरूप भी माना जाता है । इस मॉडल में इलेक्ट्रॉन नाभिक के चारों तरफ भिन्न - भिन्न कक्षाओं में इस प्रकार घूमते है जैसे विभिन्न ग्रह सूर्य के चारों तरफ विभिन्न कक्षाओं में घूमते है । इस प्रकार यह मॉडल परमाणु संरचना की व्याख्या करने का मूलभूत आधार बना परन्तु कुछ तथ्यों को समझा नहीं पाया ।
रदरफोर्ड मॉडल की कमियाँ
1 . परमाणु के स्थायित्व की व्याख्या नहीं कर सका ।
2 . परमाणु की इलेक्ट्रॉन संरचना को स्पष्ट नहीं कर पाया ।
मैक्सवेल के सिद्धांत के अनुसार वृत्ताकार घूमता हुआ इलेक्ट्रॉन विकिरण उत्सर्जित करेगा , जिससे उसकी ऊर्जा कम होती जाएगी । इस प्रकार वह नाभिक के चारों ओर सर्पिलाकार गति करता हुआ अंततः उसमें गिर जाएगा परन्तु वास्तव में ऐसा नहीं होता है । यह परमाणु के स्पेक्ट्रम तथा एक कक्षा में उपस्थित इलेक्ट्रॉन की संख्या एंव व्यवस्था को स्पष्ट नहीं करता है ।
 |
| परमाणु में e- का पथ |
नील्स बोर ने भौतिकी के क्वांटम सिद्धांतो का उपयोग कर रदरफोर्ड मॉडल के दोषों को दूर करने का प्रयास किया ।
नील्स बोर की परिकल्पना ( Hypothesis Of Neil's Bohr )
सन् 1913 में नील्स बोर ने हाइड्रोजन परमाणु की संरचना तथा उसके स्पेक्ट्रम को समझाने के लिए प्रतिरूप बनाया तथा तर्क संगत रूप से समझाया भी । बोर का परमाणु मॉडल निम्न परिकल्पनाओं पर आधारित है -
1 . परमाणु के केन्द्र में नाभिक होता है जिसमें धनावेशित कण प्रोटॉन उपस्थित होते है ।
2 . इलेक्ट्रॉन नाभिक के चारों और निश्चित त्रिज्या एवं ऊर्जा वाले पथ में गति करते है । ये निश्चित ऊर्जा वाले पथ कक्षा , कोश या ऊर्जास्तर ( Orbit Or Energy Level ) कहलाते हैं ।
3 . ये कक्षाएं नाभिक के चारों ओर सकेन्द्रिय रूप से व्यवस्थित होती है । इन्हें n से दर्शाया जाता है । इनका मान हमेशा पूर्णाक जैसे 1 , 2 , 3 , 4 , . . . . होता है तथा इन्हें क्रमशः K,L,M,N, . . . . . . . से भी प्रदर्शित किया जाता है ।
 |
| बोर का परमाणु मॉडल |
4 . n का मान बढ़ने के साथ कक्षाएँ नाभिक से दूर हो जाती है और उनकी ऊर्जा बढ़ती जाती है । n = 1 या K कक्षा की ऊर्जा सबसे कम होती है ।
5 . इन कक्षाओं में इलेक्ट्रॉन का कोणीय संवेग mvr = h/2π या इसका गुणक होता है । यहाँ h = प्लांक स्थिरांक , m = इलेक्ट्रॉन का द्रव्यमान , v = इलेक्ट्रॉन का वेग , r = कक्षा की त्रिज्या है । अर्थात् इलेक्ट्रॉन केवल उन्हीं कक्षाओं में गति कर सकता है जिनका कोणीय संवेग nh/2π के बराबर हो ।
6 . बोर के अनुसार एक निश्चित कक्षा में चक्कर लगाने पर इलेक्ट्रॉन की ऊर्जा में कोई परिवर्तन नहीं होता है ।
7 . इलेक्ट्रॉन जब परमाणु के बाहर से किसी प्रकार की ऊर्जा का अवशोषण करता है तो उत्तजित होकर उच्च ऊर्जा स्तर में चला जाता है । यदि इलेक्ट्रॉन ऊर्जा का उत्सर्जन करता है तो उच्च ऊर्जा स्तर से निम्न ऊर्जा स्तर की कक्षा में आ जाता है । परमाणु में e- द्वारा इसकी ऊर्जा अवशोषण व उत्सर्जन से रैखिक स्पैक्ट्रम का निर्माण होता है ।
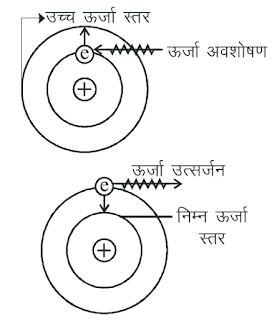 |
| इलेक्ट्रॉन द्वारा ऊर्जा का अवशोषण तथा उत्सर्जन |
बोर मॉडल की कमियाँ
यह निश्चित है कि रदरफोर्ड गॉडल से बोर का परमाणु प्रतिरूप अधिक विकसित था । इसके द्वारा परमाणु के रैखिक स्पैक्ट्रम तथा स्थायित्व की व्याख्या की जा सकी । इस मॉडल में भी कुछ प्रमुख कम्यिाँ पाई गई , जो निम्न है -
i . अधिक इलेक्ट्रॉन वाले परमाणु प्रतिरूप को इस मॉडल द्वारा स्पष्ट नहीं किया जा सका ।
ii . उच्चभेदन क्षमता वाले उपकरणों से देखने पर पता चला कि परमाणु का रैखिक स्पेक्ट्रम एक से अधिक लाइनों में बँटा होता है , जिसका कारण बोर मॉडल से स्पष्ट नहीं हो सका ।
iii . यह परमाणु द्वारा रासायनिक बंध बनाकर अणु बनाने की प्रक्रिया को स्पष्ट नहीं कर सका ।
परमाणु की संरचना ज्ञात करने के साथ - साथ अनेक प्रकार के तत्वों की भी खोज हो रही थी । इन तत्वों के प्रतीक परमाणु संरचना तथा विशेष गुणों को स्पष्ट रूप से पहचाना भी गया । अब तक यह तो ज्ञात हो ही चुका था कि सभी पदार्थ तत्वों के परमाणुओं से बने होते है । इन तत्वों से सम्बन्धित जानकारियों को व्यवस्थित करने का प्रयास किया जा रहा था ।
Also Read - पेंचमापी ( स्क्रूगेज ) का सिद्धांत तथा बनावट [Screw Gauge]
